Notre équipe se concentre sur les aspects moléculaires de l’initiation et de la progression du cancer pancréatique afin d’améliorer les approches thérapeutiques actuellement disponibles.
Le cancer du pancréas est l'une des principales causes de décès par cancer dans le monde. En 2020, environ 466 000 personnes en sont décédées. Malgré les avancées en recherche, le pronostic reste sombre, avec une survie nette à cinq ans d'environ 11 % pour les cas diagnostiqués entre 2010 et 2015. Cette létalité élevée s'explique par un diagnostic souvent tardif, des options thérapeutiques limitées, une nature agressive et une résistance notable à la chimiothérapie. De plus, une hétérogénéité significative est observée parmi les patients, résultant de mutations génétiques variées, d'interactions complexes avec le microenvironnement tumoral et de la pression de sélection conduisant à l'expansion clonale.
Notre équipe se concentre sur les aspects moléculaires du développement et de la progression du cancer du pancréas afin d'améliorer les approches thérapeutiques actuelles. Nos recherches s'articulent autour de trois axes principaux :
- La signalisation et le métabolisme : en étudiant le ciblage de NUPR1 pour le traitement du PDAC (Juan Iovanna et Patricia Santofimia-Castaño).
- Dialogues entre molécules d’adhérence dans le cancer du pancréas : en étudiant le profil d’expression des cadhérines et leur rôle dans l’invasion tumorale (Frédéric André et Véronique Rigot).
- La recherche translationnelle : en étudiant le développement de traitements personnalisés pour le PDAC (Nelson Dusetti et Juan Iovanna), le rôle des processus de glycosylation anormaux dans la progression du PDAC (Eric Mas), le rôle des modifications post-traductionnelles (PTM) dans la biologie et mécanismes de résistance du PDAC (Philippe Soubeyran), et le ciblage des phénotypes résistants du PDAC (Nicolas Frauhoffer).
Les projets
Project members :
NUPR1, une protéine nucléaire intrinsèquement désordonnée (IDP), qui joue un rôle crucial dans le cancer du pancréas (PDAC) ainsi que dans d'autres types de cancers. NUPR1 joue un rôle crucial dans la régulation de la croissance tumorale, et son inactivation génétique entraîne un arrêt complet du développement tumoral. En raison des caractéristiques structurelles uniques des protéines intrinsèquement désordonnées, le développement d'inhibiteurs spécifiques pour NUPR1 reste un défi majeur. Notre équipe s'attaque à cette problématique en utilisant des approches innovantes et multidisciplinaires. Grâce à nos recherches, nous avons découvert ZZW-115, un composé anticancéreux puissant testé in vitro et in vivo. L'utilisation de ZZW-115 a permis d'observer une régression tumorale dose-dépendante chez des souris xénogreffées, sans effets secondaires apparents. Nos analyses cellulaires ont révélé que ZZW-115 induit la nécroptose, l'apoptose et la ferroptose, en réponse à une déstabilisation mitochondriale, mettant en lumière son potentiel thérapeutique. Les résultats les plus récents de nos travaux ont montré que ZZW-115 inhibe la formation des granules de stress dépendants de NUPR1, freinant ainsi la progression des néoplasies intraépithéliales pancréatiques (PanINs) chez des souris porteuses de la mutation oncogénique KrasG12D. Cette inhibition a conduit à la mort cellulaire, à l'activation de la caspase 3, à la fragmentation de l'ADN et à la formation de corps apoptotiques après un traitement de quatre semaines. Notre équipe continue d'explorer ces mécanismes pour offrir de nouvelles perspectives thérapeutiques dans la lutte contre les cancers dépendants de NUPR1.
La recherche en cours se concentre sur le mécanisme d'action de ZZW-115, les partenaires moléculaires de NUPR1, sa synergie avec les agents endommageant l'ADN et les études précliniques réglementaires. Le composé ZZW-115 a été protégé par un brevet et une start-up (PanCa Therapeutics) pour l’amener vers les essais cliniques a été créé.
- Targeting NUPR1-dependent stress granules formation to induce synthetic lethality in KrasG12D-driven tumors. Santofimia-Castaño P, Fraunhoffer N, Liu X, Bessone IF, di Magliano MP, Audebert S, Camoin L, Estaras M, Brenière M, Modesti M, Lomberk G, Urrutia R, Soubeyran P, Neira JL, Iovanna J. EMBO Mol Med. 2024 Feb 15.
- NUPR1 protects against hyperPARylation-dependent cell death. Santofimia-Castaño P, Huang C, Liu X, Xia Y, Audebert S, Camoin L, Peng L, Lomberk G, Urrutia R, Soubeyran P, Neira JL, Iovanna J. Commun Biol. 2022 Jul 22;5(1):732.
- NUPR1 inhibitor ZZW-115 induces ferroptosis in a mitochondria-dependent manner. Huang C, Santofimia-Castaño P, Liu X, Xia Y, Peng L, Gotorbe C, Neira JL, Tang D, Pouyssegur J, Iovanna J. Cell Death Discov. 2021 Oct 1;7(1):269.
- ZZW-115-dependent inhibition of NUPR1 nuclear translocation sensitizes cancer cells to genotoxic agents. Lan W, Santofimia-Castaño P, Swayden M, Xia Y, Zhou Z, Audebert S, Camoin L, Huang C, Peng L, Jiménez-Alesanco A, Velázquez-Campoy A, Abián O, Lomberk G, Urrutia R, Rizzuti B, Geli V, Soubeyran P, Neira JL, Iovanna J. JCI Insight. 2020 Sep 17;5(18):e138117.
- Ligand-based design identifies a potent NUPR1 inhibitor exerting anticancer activity via necroptosis. Santofimia-Castaño P, Xia Y, Lan W, Zhou Z, Huang C, Peng L, Soubeyran P, Velázquez-Campoy A, Abián O, Rizzuti B, Neira JL, Iovanna J. J Clin Invest. 2019 Mar 28;129(6):2500-2513.
Membres du projet :
- 1. Nous déterminons une signature « Cadhérines » correspondant au profil d’expression des cadhérines en lien avec un invagramme (invasivité 3D des cellules tumorales, capacité à former des invadopodes,…). Le but de cette approche est de prédire l’agressivité du PDAC, permettant un suivi personnalisé des patients.
- 2. Nous avons identifié une cadhérine dont la forte expression est associée à un très mauvais pronostic chez le patient. Nous tentons de comprendre son implication fonctionnelle dans l’agressivité tumorale. Des outils thérapeutiques et pronostic ciblant cette molécule sont actuellement en cours de développement.
- 3. Nous tentons de caractériser si la nature des cadhérines exprimées par les cellules tumorales impacte qualitativement et quantitativement la composition de la matrice extracellulaire
- E-cadherin is a structuring component of invadopodia in pancreatic cancerDobric A, Germain S, Silvy F, Bonier R, Audebert S, Camoin L, Dusetti N, Soubeyran P, Iovanna J, Rigot V, André F. 2020/10/9, bioRxiv, 2020.10.09.332783.
- Cadherin-1 and cadherin-3 cooperation determines the aggressiveness of pancreatic ductal adenocarcinoma. Siret C, Dobric A, Martirosyan A, Terciolo C, Germain S, Bonier R, Dirami T, Dusetti N, Tomasini R, Rubis M, Garcia S, Iovanna J, Lombardo D, Rigot V, André F. Br J Cancer. 2018 Feb 20;118(4):546-557.
Le profil d’expression et la localisation des cadhérines sont modulés lors de progression du PDAC. Nous analysons l’implication des différentes cadhérines lors de la cascade invasion/métastase. Nos objectifs sont de définir une signature cadhérine qui rende compte de l’agressivité du PDAC et de développer un ciblage thérapeutique pour au moins l'une d'entre elle.
Membres du projet :
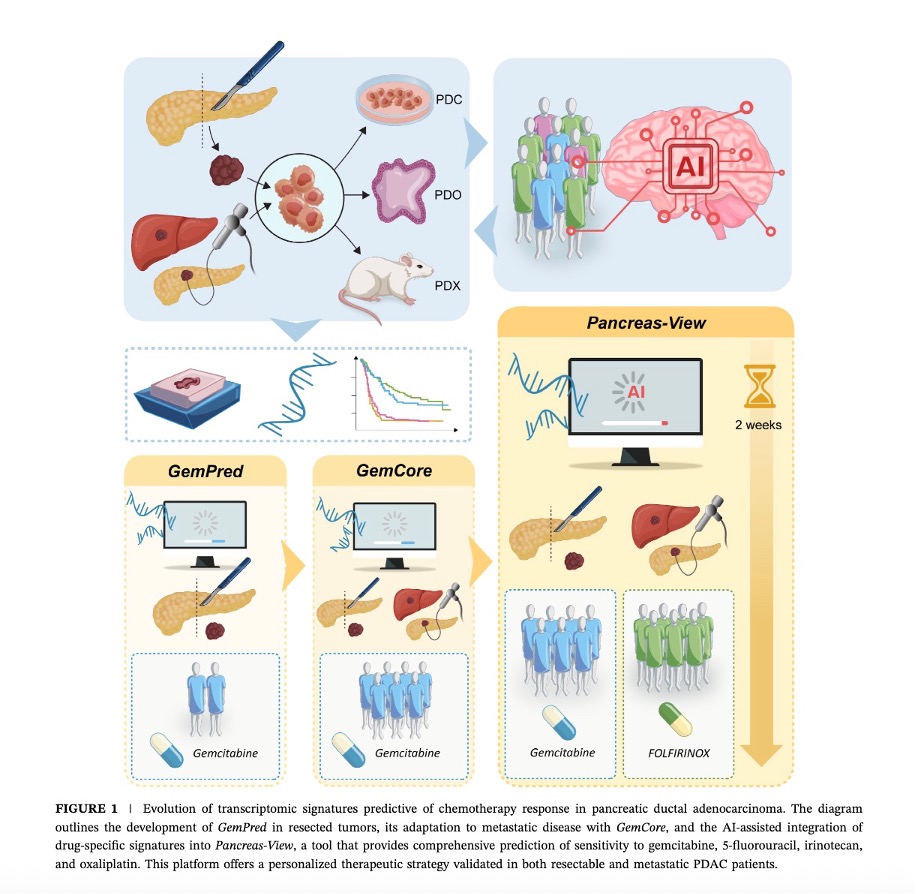
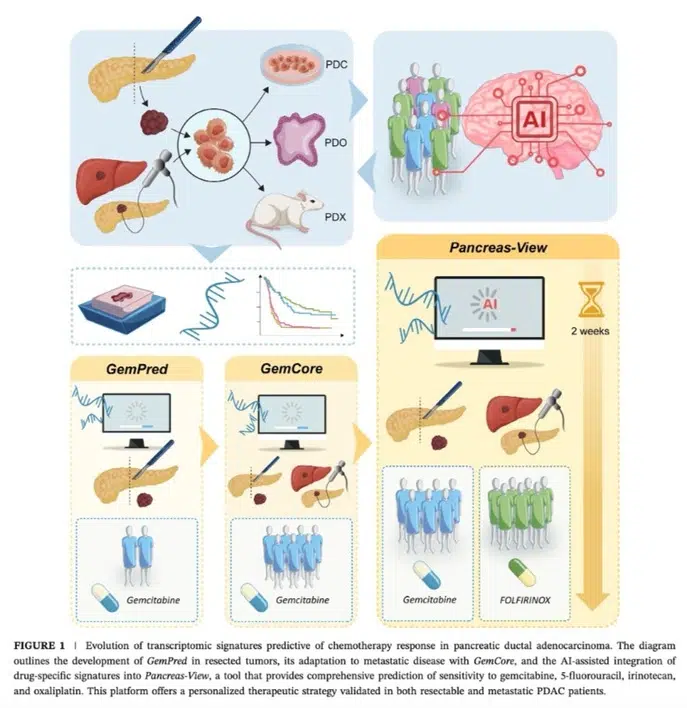
Nous avons validé l’efficacité des signatures au cours de plusieurs études rétrospectives, et nos travaux en cours portent sur leur validation clinique dans des cohortes prospectives. L’algorithme Pancreas-View, protégé par un brevet, a donné naissance à une start-up, Predicting Med, créée pour en assurer le développement industriel. Cette initiative vise à intégrer cet outil innovant dans la pratique clinique courante, afin d’améliorer la prise en charge des cancers du pancréas.
- Development and validation of AI-assisted transcriptomic signatures to personalize adjuvant chemotherapy in patients with pancreatic ductal adenocarcinoma. Fraunhoffer N, Hammel P, Conroy T, Nicolle R, Bachet JB, Harlé A, Rebours V, Turpin A, Ben Abdelghani M, Mitry E, Biagi J, Chanez B, Bigonnet M, Lopez A, Evesque L, Lecomte T, Assenat E, Bouché O, Renouf DJ, Lambert A, Monard L, Mauduit M, Cros J, Iovanna J, Dusetti N. Ann Oncol. 2024 Sep;35(9):780-791. doi: 10.1016/j.annonc.2024.06.010. Epub 2024 Jun 19. PMID: 38906254
- Prediction of Adjuvant Gemcitabine Sensitivity in Resectable Pancreatic Adenocarcinoma Using the GemPred RNA Signature: An Ancillary Study of the PRODIGE-24/CCTG PA6 Clinical Trial. Nicolle R, Bachet JB, Harlé A, Iovanna J, Hammel P, Rebours V, Turpin A, Ben Abdelghani M, Wei A, Mitry E, Lopez A, Biagi J, François E, Artru P, Lambert A, Renouf DJ, Monard L, Mauduit M, Dusetti N, Conroy T, Cros J. J Clin Oncol. 2023 Nov 14:JCO2202668.
- A Transcriptomic-Based Tool to Predict Gemcitabine Sensitivity in Advanced Pancreatic Adenocarcinoma.Fraunhoffer N, Chanez B, Teyssedou C; Pdac Chemo Sensitivity Prediction Working Group; Iovanna JL, Mitry E, Dusetti NJ. Gastroenterology. 2023 Mar;164(3):476-480.e4.
- A transcriptomic signature to predict adjuvant gemcitabine sensitivity in pancreatic adenocarcinoma.Nicolle R, Gayet O, Duconseil P, Vanbrugghe C, Roques J, Bigonnet M, Blum Y, Elarouci N, Armenoult L, Ayadi M, de Reyniès A, Puleo F, Augustin J, Emile JF, Svrcek M, Arsenijevic T, Hammel P, Giovannini M, Grandval P, Dahan L, Moutardier V, Gilabert M, Van Laethem JL, Bachet JB, Cros J, Iovanna J, Dusetti NJ. Ann Oncol. 2021 Feb;32(2):250-260.
Membres du projet :
L'identification des phénotypes résistants dans le PDAC a permis de révéler une multitude de molécules spécifiquement modulées dans ces conditions. Ces molécules représentent des cibles thérapeutiques potentielles ainsi que de nouveaux biomarqueurs pour mieux comprendre et contrer la résistance aux traitements. Ce projet vise à explorer ces marqueurs en détail à travers des modèles précliniques avancés, tels que des cultures cellulaires dérivées de patients (PDC), des organoïdes (PDO) et des xénogreffes dérivées de tumeurs humaines (PDX). En combinant des techniques de pointe comme CRISPR-Cas9 pour inhiber spécifiquement les gènes associés à la chimiorésistance, et des approches épigénomiques pour moduler leur expression, nous espérons transformer les cellules résistantes en cellules sensibles. Par ailleurs, les analyses transcriptomiques spatiales et unicellulaires permettent d'identifier les interactions complexes entre les cellules épithéliales tumorales et le microenvironnement tumoral (CAF, cellules immunitaires) dans un contexte de traitement. Ces analyses fournissent des outils pour prédire les réponses aux traitements et ciblent des sous-populations cellulaires spécifiques.En adoptant cette approche multidisciplinaire, notre objectif est de développer des stratégies thérapeutiques innovantes capables de surmonter la résistance tumorale, améliorant ainsi l'efficacité des chimiothérapies et ouvrant de nouvelles perspectives pour la prise en charge du PDAC.
- Priming therapy by targeting enhancer-initiated pathways in patient-derived pancreatic cancer cells. Fraunhoffer NA, Moreno Vega AI, Abuelafia AM, Morvan M, Lebarbier E, Mary-Huard T, Zimmermann MT, Lomberk G, Urrutia R, Dusetti N, Blum Y, Nicolle R, Iovanna J. EBioMedicine. 2023 Jun;92:104602. doi: 10.1016/j.ebiom.2023.104602. Epub 2023 May 4. PMID: 37148583
- Inhibition of glucuronidation in pancreatic cancer improves gemcitabine anticancer activity. Fraunhoffer NA, Abuelafia AM, Chanez B, Bigonnet M, Gayet O, Roques J, Chuluyan E, Dusetti N, Iovanna J. Cancer Commun (Lond). 2022 Nov;42(11):1212-1216. doi: 10.1002/cac2.12365. Epub 2022 Sep 30. PMID: 36178036
- Multi-omics data integration and modeling unravels new mechanisms for pancreatic cancer and improves prognostic prediction.Fraunhoffer NA, Abuelafia AM, Bigonnet M, Gayet O, Roques J, Nicolle R, Lomberk G, Urrutia R, Dusetti N, Iovanna J. NPJ Precis Oncol. 2022 Aug 17;6(1):57. doi: 10.1038/s41698-022-00299-z. PMID: 35978026
Membres du projet :
Les modifications post-traductionnelles de type ubiquitine (ubiquitine et protéines apparentées comme les SUMOs et Nedd8) régulent les fonctions de toutes les protéines cellulaires et sont donc impliquées dans la plupart des processus biologiques d'une cellule. Des altérations de ce type de MPT peuvent être impliquées dans des processus oncogéniques et être responsables de mécanismes de résistance permettant à la cellule cancéreuse de survivre aux divers traitements anti-cancéreux.Notre but est de traquer ces altérations associées au cancer du pancréas pour, d'une part, s'en servir de marqueurs de chimio-résistance et, d'autre part, s'en servir comme nouvelles cibles moléculaires de re-sensibilisation. Ainsi, rétablir une MPT normale de certaines de ces cibles a le potentiel de rétablir la sensibilité des cellules cancéreuses pancréatiques aux traitements conventionnels, augmentant ainsi leur efficacité et donc la survie des patients.
- Pancreatic ductal adenocarcinoma ubiquitination profiling reveals specific prognostic and theranostic markers. El Kaoutari A, Fraunhoffer NA, Audebert S, Camoin L, Berthois Y, Gayet O, Roques J, Bigonnet M, Bongrain C, Ciccolini J, Iovanna JL, Dusetti NJ, Soubeyran P. EBioMedicine. 2023 Jun;92:104634.
- PML hyposumoylation is responsible for the resistance of pancreatic cancer. Swayden M, Alzeeb G, Masoud R, Berthois Y, Audebert S, Camoin L, Hannouche L, Vachon H, Gayet O, Bigonnet M, Roques J, Silvy F, Carrier A, Dusetti N, Iovanna JL, Soubeyran P. FASEB J. 2019 Nov;33(11):12447-12463.
Membres du projet :
Une des causes principales de la résistance du PDAC aux traitements est une variabilité génotypique et phénotypique très importante entre les tumeurs de patients qui fait intervenir des mécanismes moléculaires variés et complexes. Parmi ces mécanismes, nous retrouvons les processus de glycosylation qui sont à l’origine de l’apparition de structures glycosylées anormales dont l’expression est variable entre les tumeurs de patients.Ces structures peuvent être générées sur les glycoprotéines et les glycosphingolipides suite à une altération profonde, entre autres, de l’expression des enzymes de la glycosylation, telles que les glycosyltransférases. Ces glycanes aberrants contribuent ainsi fortement à cette hétérogénéité tumorale et peuvent participer à la transformation maligne, la progression tumorale et la dissémination métastatique.
Dernièrement nous avons montré que certains de ces glyco-gènes pouvaient être corrélés à la sensibilité ou à la résistance des cellules tumorales à diverses molécules thérapeutiques.
Notre projet vise donc à caractériser l’impact moléculaire et clinique de ces glycosyltransférases et des glycanes aberrants qu’elles produisent. L’objectif est de déterminer leur potentiel en tant que glyco-biomarqueurs histologiques prédictifs de la réponse aux traitements. Par ailleurs, nous explorons leurs rôles dans les mécanismes moléculaires impliqués à la fois dans la progression tumorale et dans la modulation de la sensibilité ou de la résistance aux chimiothérapies.
- A glycosyltransferase gene signature to detect pancreatic ductal adenocarcinoma patients with poor prognosis. Mohamed Abd-El-Halim Y, El Kaoutari A, Silvy F, Rubis M, Bigonnet M, Roques J, Cros J, Nicolle R, Iovanna J, Dusetti N, Mas E. EBioMedicine. 2021 Sep;71:103541.
Les actualités de l’équipe
les publications à la une
09/2024
Fraunhoffer N, Hammel P, Conroy T, Nicolle R, Bachet JB, Harlé A, Rebours V, Turpin A, Ben Abdelghani M, Mitry E, Biagi J, Chanez B, Bigonnet M, Lopez A, Evesque L, Lecomte T, Assenat E, Bouché O, Renouf DJ, Lambert A, Monard L, Mauduit M, Cros J, Iovanna J, Dusetti N.
03/2024
Santofimia-Castaño P, Fraunhoffer N, Liu X, Bessone IF, di Magliano MP, Audebert S, Camoin L, Estaras M, Brenière M, Modesti M, Lomberk G, Urrutia R, Soubeyran P, Neira JL, Iovanna J.
03/2023
Fraunhoffer N, Chanez B, Teyssedou C; Pdac Chemo Sensitivity Prediction Working Group; Iovanna JL, Mitry E, Dusetti NJ.
08/2022
Fraunhoffer NA, Abuelafia AM, Bigonnet M, Gayet O, Roques J, Nicolle R, Lomberk G, Urrutia R, Dusetti N, Iovanna J.
05/2021
Cano CE, José Sandí M, Hamidi T, Calvo EL, Turrini O, Bartholin L, Loncle C, Secq V, Garcia S, Lomberk G, Kroemer G, Urrutia R, Iovanna JL.
02/2021
Nicolle R, Gayet O, Duconseil P, Vanbrugghe C, Roques J, Bigonnet M, Blum Y, Elarouci N, Armenoult L, Ayadi M, de Reyniès A, Puleo F, Augustin J, Emile JF, Svrcek M, Arsenijevic T, Hammel P, Giovannini M, Grandval P, Dahan L, Moutardier V, Gilabert M, Van Laethem JL, Bachet JB, Cros J, Iovanna J, Dusetti NJ.


Labels, Financements et Partenaires
Comme d'autres, ils ont fait partie de l'équipe. Merci à tous ceux qui ont contribué à l'excellence et à l'impact du CRCM.